此條目需要补充更多来源。 (2025年4月5日) |

氧化還原反應(英語:reduction–oxidation,直译:「還原氧化反應」,Redox /ˈrɛdɒks/ RED-oks,或 /ˈriːdɒks/ REE-doks[1];也稱oxidation–reduction[2])是一種化學反應,在這種反應中,一個基質的氧化態發生變化[3]。这种反应可以理解成由两个半反应构成,即氧化反应和还原反应,而反应前后元素的氧化数具有相应的升降变化。氧化是指失去電子或氧化態的增加,而還原則是指獲得電子或氧化態的降低。此类反应都遵守电荷守恒。在氧化還原反應裡,氧化與還原必然以等量同時進行。
定義
氧化還原反應有兩種類型:
- 電子轉移-通常只有一個電子從被氧化的原子流向被還原的原子。這類型的氧化還原反應經常以氧化還原對和電極電位來討論。
- 原子轉移-原子從一個基質轉移到另一個基質。例如,在鐵的生鏽過程中,鐵原子的氧化態增加,因為鐵轉化為氧化物,同時氧的氧化態降低,因為它接受了由鐵釋放的電子。雖然氧化反應通常與氧化物的形成有關,但其他化學物質也可以起到相同的作用。[4]在氫化反應中,像C=C這樣的鍵通過氫原子的轉移被還原。
还原剂 + 氧化剂 → 氧化产物(氧化数升高) + 还原产物(氧化数降低)
一般来说,同一反应中还原产物的还原性比还原剂弱,氧化产物的氧化性比氧化剂弱,这就是所谓“强还原剂制弱还原剂,强氧化剂制弱氧化剂”。換言之:
舉個例子︰
被氧化(oxidized), 被還原(reduced)。
根據反應的實際情況,氧化還原有不同的定義:
根據電子得失
- 氧化:失去電子。
- 還原:得到電子。
這個是最基本、終極的氧化還原的定義,也是廣義氧化還原的定義[5]。
根據氧化數
- 氧化:氧化數升高
- 還原:氧化數降低
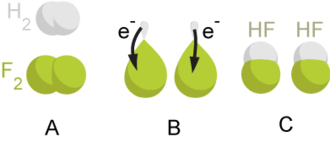
有時候很難以電子得失作判斷(例如哈伯法裏面氫氣和氮氣的反應[6],生成物氨並不是離子化合物,電子由雙方共有,沒有一方原子「接受」或「給出」電子),那麽就可以利用氧化數判斷哪一方是被氧化、還原。
根據氧的得失
- 氧化:得到氧
- 還原:失去氧
得到氧叫氧化,是最直接的想法。可是因爲不是每個反應都涉及到氧的得失(例如金屬鈉和氯氣的反應),所以這個是狹義氧化還原的定義。
根據氫的得失
- 氧化:失去氫
- 還原:得到氫
是一個不太普遍的定義,常用於有機化學、生物化學。例子:一級醇氧化到醛的過程中,碳失去了一個氫,因此那是氧化反應。三級醇不能被氧化劑氧化,原因正是三級碳上沒有氫。而加氫反應(烯烴生成烷烴、苯的伯奇還原[7]等)等是還原反應。
範例
以酸性条件下過錳酸鹽()與草酸根()做为例子,发生还原反应,故为氧化剂,发生氧化反应,故为还原剂。其还原半反应式为:
而氧化半反应式为:
将两式中的电子消除得到:
特别例子: 应该注意的是,部分物质在某反应中是氧化剂,在另一个反应中却是还原剂。二氧化硫就是一个例子。以下方程式为二氧化硫与氧反应,形成三氧化硫:
在这反应中,二氧化硫被氧化,因为硫的氧化数由4 增加至6,二氧化硫是还原剂。 现在再看看另一个例子。 二氧化硫与硫化氢的反应:
在这反应中,二氧化硫被还原成硫,二氧化硫是氧化剂。
所以不可以简单地说「某物质是氧化剂或还原剂」,需要说明某物质与什么物质进行化学反应。
表现
无机物
无机物的氧化还原反应表现为一种元素与其他元素化合比例发生了变化。
很多可与氧、氯、硫单质化合的物质在反应中都被氧化。大多数气态非金属单质都是较好的氧化剂,而碱金属都是还原剂。氢气、一氧化碳等还原性气体能把金属从它们的氧化物中提炼出来,这种还原反应在工业上有重要用途。
氧化反应最早是指金属或非金属与氧化合形成氧化物的反应,而还原反应最早是指金属从其化合物中被还原成单质的反应。
有可变价态的金属元素,其高价态离子一般有氧化性,低价态离子一般有还原性。如重铬酸根(Cr(VI))、铁离子(Fe(III))等是氧化剂,2价锡离子、2价钒离子等是还原剂。
有机物
有机物因此而导致的基团变化。有机物的反应也需要氧化剂和还原剂,而且有机分子中的碳原子的氧化数一样会发生变化。确切的说,发生氧化数变化的碳原子仅限于涉及变化了的基团的少数几个碳原子,但为了计算方便,计算时可以取平均价态。
双键和三键可以被氧化剂氧化而断开。含氧基团的转变也属于氧化还原反应,涉及此类反应的基团包括醇羟基、醛基、酮基和羧基。在适宜的条件下,它们可以互相转变。另外,多数有α-氢的芳香环取代基能被高锰酸钾氧化为羧基。
这些反应一般用高锰酸钾、臭氧、重铬酸钾等强氧化性物质作氧化剂,一些有机金属化合物(如硼氫化鈉、氫化鋁鋰等)及其他有活泼键的强还原性物质作还原剂。
應用
生物學

許多重要的生物過程都涉及氧化還原反應。在這些過程開始之前,必須從環境中吸收鐵。[8]
例如,細胞呼吸作用是葡萄糖( C6H12O6)氧化為CO2,氧氣還原為水。呼吸作用的總結方程式為:
- C
6H
12O
6 + 6 O
2 → 6 CO
2 + 6 H
2O + 能量
呼吸作用過程也很大程度上依賴NAD+還原為NADH及其逆反應(NADH氧化為NAD+)。光合作用和呼吸作用是互補的,但光合作用並不是呼吸作用中氧化還原反應的逆反應:
- 6 CO
2 + 6 H
2O + 光能 → C
6H
12O
6 + 6 O
2
生物能量通常通过氧化还原反应来储存和释放。光合作用涉及将二氧化碳还原为糖,将水氧化为分子氧。逆反应呼吸将糖氧化为二氧化碳和水。作为中间步骤,还原碳化合物用于将烟酰胺腺嘌呤二核苷酸 (NAD+) 还原为NADH,然后有助于产生质子梯度,从而驱动三磷酸腺苷 (ATP) 的合成,并通过氧气的还原来维持。在动物细胞中,线粒体发挥类似的功能。
地質學

礦物質通常是金屬的氧化衍生物。鐵以磁鐵礦(Fe3O4)的形式開採。鈦以二氧化物的形式開採,通常為金紅石(TiO2)的形式。這些氧化物必須被還原才能得到相應的金屬,通常透過將這些氧化物與碳或一氧化碳作為還原劑加熱來實現。高爐是將氧化鐵和焦炭(碳的一種形式)混合以生產熔鐵的反應爐。產生鐵水的主要化學反應是:[9]
- Fe
2O
3 + 3 CO → 2 Fe + 3 CO
2
電子轉移反應是土壤中無數過程和特性的核心,氧化還原電位(量化為Eh(相對於標準氫電極的鉑電極電位(電壓))或pe(類似於pH的對比電子活度))與pH一樣,是控制化學反應和生物過程的主要變量。早期的理論研究應用於淹水土壤和水稻田生產,對後來土壤中氧化還原和植物根系生長的熱力學研究具有開創性意義。[10]後來的工作則建立在此基礎上,並加以擴展,以瞭解與重金屬氧化狀態變化、成土作用與形態、有機化合物降解與形成、自由基化學、濕地劃分、土壤修復等相關的氧化還原反應,以及各種表徵土壤氧化還原狀態的方法。[11][12]
工業
通常氧化还原反应可以做成一个原电池。其中发生氧化反应的一极为阳极,即外电路的负极;还原反应的一极为阴极,即外电路的正极。两个电极之间有电势差(电化学上通常叫电动势),因此反应可以进行,同时可以用来做功。
氧化還原反應的单元过程在化学工业生产中非常重要,用于许多化合物的制备:
- 將硫化铁氧化成二氧化硫,再将二氧化硫氧化成三氧化硫,以制备硫酸
- 氮氧化成一氧化氮(以鉑作為催化劑),再将一氧化氮氧化成二氧化氮以制备硝酸
- 使用氧化還原反應將磷轉化成五氧化二磷制备磷酸
- 使用氧化還原反應將乙烯轉化成环氧乙烷
- 使用氧化還原反應將甲醇轉化成氢和甲醛
- 使用氧化還原反應將氯化氫轉化成氯氣和水
其中,还原过程在工业中的应用有:
一般工业常用的还原剂有氢气、一氧化碳、铁屑、锌粉等易于被氧化而氧化后生成无害产物的物质。
在化工领域,目的通常只是在于所要得到的产品,氧化过程是要得到氧化产物,并不关心氧化剂的变化,还原也是只关心还原产物,不在乎还原剂,所以两种过程不能放到一起。
参见
參考資料
- ^ redox – definition of redox in English | Oxford Dictionaries. Oxford Dictionaries | English. [2017-05-15]. (原始内容存档于2017-10-01).
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey. General Chemistry 8th. Prentice-Hall. 2002: 150. ISBN 0-13-014329-4.
- ^ Redox Reactions. wiley.com. [2012-05-09]. (原始内容存档于2012-05-30).
- ^ Haustein, Catherine Hinga. Oxidation-reduction reaction. K. Lee Lerner; Brenda Wilmoth Lerner (编). The Gale Encyclopedia of Science 5th. Farmington Hills, MI: Gale Group. 2014.
- ^ epaper777. 有機物化合物的氧化與還原反應. 大學入學考試中心. [2021-06-17]. (原始内容存档于2021-06-28).
- ^ Appl, Max, Wiley-VCH Verlag GmbH & Co. KGaA , 编, Ammonia, Wiley-VCH Verlag GmbH & Co. KGaA, 2006-12-15 [2025-03-12], ISBN 978-3-527-30673-2, doi:10.1002/14356007.a02_143.pub2 (英语)
- ^ (a) Birch, A. J. J. Chem. Soc. 1944, 430. (b) Birch, A. J. J. Chem. Soc. 1945, 809. (c) Birch, A. J. J. Chem. Soc. 1946, 593. (d) Birch, A. J. J. Chem. Soc. 1947, 102 & 1642. (e) Birch, A. J. J. Chem. Soc. 1949, 2531.
- ^ Kroneck, Peter; Sosa Torres, Martha (编), Titles of Volumes 1–44 in the Metal Ions in Biological Systems Series, De Gruyter: xxiii–xxiv, 2021-01-18 [2025-03-12], ISBN 978-3-11-058977-1, doi:10.1515/9783110589771-005
- ^ Oeters, Franz; Ottow, Manfred; Meiler, Heinrich; Lüngen, Hans Bodo; Koltermann, Manfred; Buhr, Andreas; Yagi, Jun-Ichiro; Formanek, Lothar; Rose, Iron, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a14_461.pub2
- ^ Ponnamperuma, F.N. The Chemistry of Submerged Soils. Advances in Agronomy 24. 1972: 29–96. ISBN 978-0-12-000724-0. doi:10.1016/S0065-2113(08)60633-1.
- ^ Bartlett, Richmond J.; James, Bruce R. Redox chemistry of soils. Advances in Agronomy. 1991, 39: 151–208.
- ^ James, Bruce R.; Brose, Dominic A. Oxidation-reduction phenomena. Huang, Pan Ming; Li, Yuncong; Sumner, Malcolm E. (编). Handbook of soil sciences: properties and processes second. Boca Raton, Florida: CRC Press. 2012: 14–1 –– 14–24. ISBN 978-1-4398-0305-9.
外部链接
- (英文)Chemical Equation Balancer (页面存档备份,存于互联网档案馆) – An open-source chemical equation balancer that handles redox reactions.
- (英文)Redox reactions calculator (页面存档备份,存于互联网档案馆)
- (英文)Redox reactions at Chemguide (页面存档备份,存于互联网档案馆)
- (英文)Online redox reaction equation balancer, balances equations of any half-cell and full reactions (页面存档备份,存于互联网档案馆)
























